Otra forma de luchar !
Hipertermia en oncología
La hipertermia oncológica consiste en la aplicación controlada de calor (entre 39 °C y 45 °C) como tratamiento complementario en oncología. No pretende destruir directamente el tumor, sino actuar como un potente sensibilizador biológico, potenciando la eficacia de la radioterapia y la quimioterapia.
Beneficios validados por evidencia de alto nivel (ensayos clínicos de fase III y metaanálisis):
- Mejora en la supervivencia global (SG) y la tasa de respuesta completa (RC).
- Reducción significativa del riesgo de recurrencia local en varios tipos de cáncer.
- Seguridad demostrada, sin aumento significativo de toxicidad grave.
HY-DEEP 600WM
Un dispositivo de radiofrecuencia capacitiva innovador, concebido para ofrecer un tratamiento altamente específico, seguro y no invasivo.
- Potencia máxima: 600 W (modo OK, ciclo al 77%)
- Frecuencia de transmisión: 13,56 MHz
- Refrigeración por agua regulable: 6-28 °C
- Clasificación: Clase II B-93/42/CEE
- Peso: 170 kg
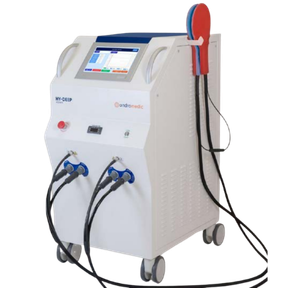
Características y principales ventajas del HY-DEEP 600WM
Sistema de modulación térmica (TMS) con biorresonancia para un calentamiento homogéneo.
Control de la temperatura en tiempo real para una focalización térmica precisa.
Base de datos clínicas integrada en un software de análisis avanzado.
Antenas refrigeradas (170 mm / 270 mm) adaptadas a diversos sitios anatómicos.
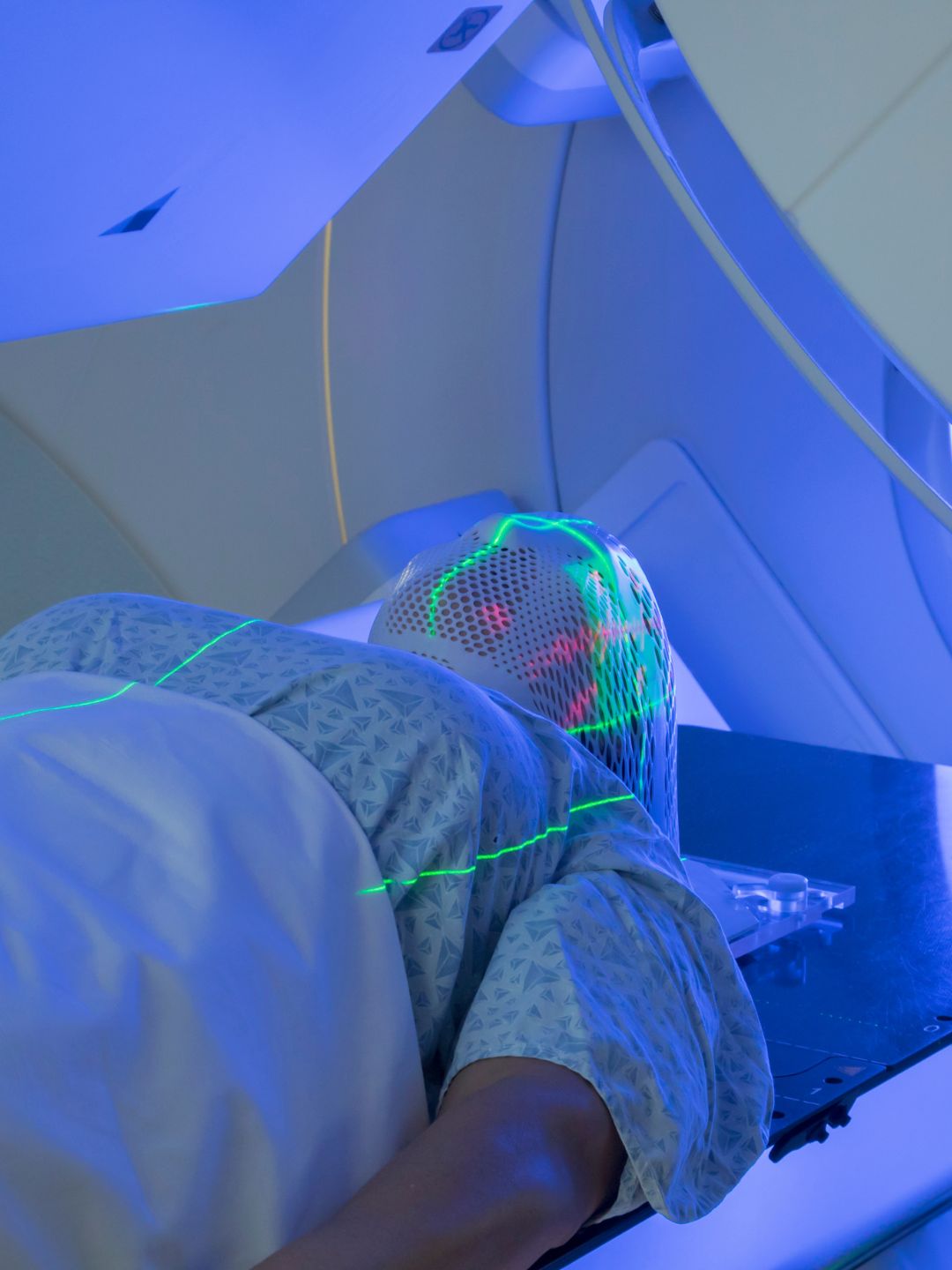
¿Cómo funciona?
La hipertermia oncológica actúa a varios niveles biológicos aprovechando una característica clave: las células cancerosas tienen una mayor sensibilidad al calor en comparación con las células normales.
El tratamiento consiste en calentar el tumor, generalmente a una temperatura de unos 42,5 °C, mediante energía de microondas o radiofrecuencia. Este aumento controlado de la temperatura se basa en el principio de que el calor daña preferentemente a las células tumorales. Su vascularización desorganizada e ineficiente impide la disipación adecuada del exceso de calor, lo que provoca su desestabilización y destrucción. Por el contrario, las células sanas, con una red vascular funcional y regular, pueden disipar el calor sin sufrir daños significativos.
La hipertermia se dirige específicamente a las células tumorales en la fase S del ciclo celular, un período en el que la radioterapia y la quimioterapia suelen ser menos eficaces. Esta especificidad confiere a la hipertermia un efecto sinérgico: potencia la eficacia de estos tratamientos convencionales y contribuye a mejorar la respuesta terapéutica general del paciente.
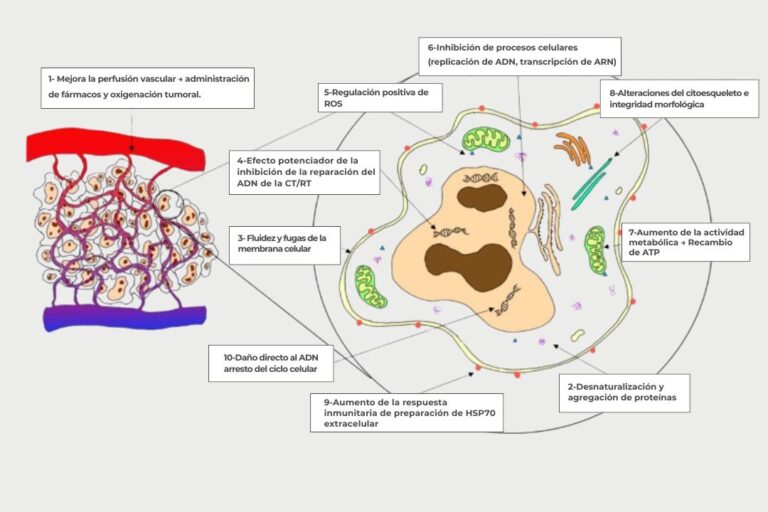
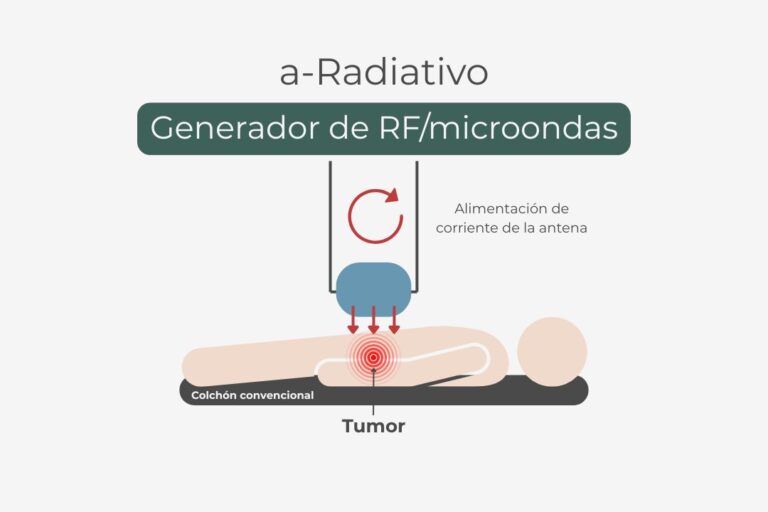
1. Efecto sobre la radioterapia (radiosensibilización)
Los tumores sólidos a menudo tienen áreas poco oxigenadas (hipóxicas), lo que los hace más resistentes a la radioterapia.
El aumento de la temperatura (40–43 °C) provoca vasodilatación y mejora el flujo sanguíneo al tumor.
Resultado: el tumor recibe más oxígeno → lo que aumenta la eficacia de los rayos X, porque el oxígeno promueve la producción de radicales libres capaces de romper el ADN tumoral.
Además, el calor bloquea los mecanismos de reparación del ADN dañado en las células cancerosas → por lo tanto se vuelven más vulnerables a la RT.
2. Efecto sobre la quimioterapia (quimiosensibilización)
El calor provoca un aumento de la permeabilidad de las membranas celulares: los medicamentos penetran más fácilmente en la célula tumoral.
Se mejora la microcirculación sanguínea en el tumor → lo que favorece la distribución de agentes quimioterapéuticos.
Algunos fármacos como el cisplatino, la mitomicina C o la doxorrubicina tienen su actividad citotóxica amplificada por el calor, porque las reacciones químicas que dañan el ADN son más eficientes a altas temperaturas.
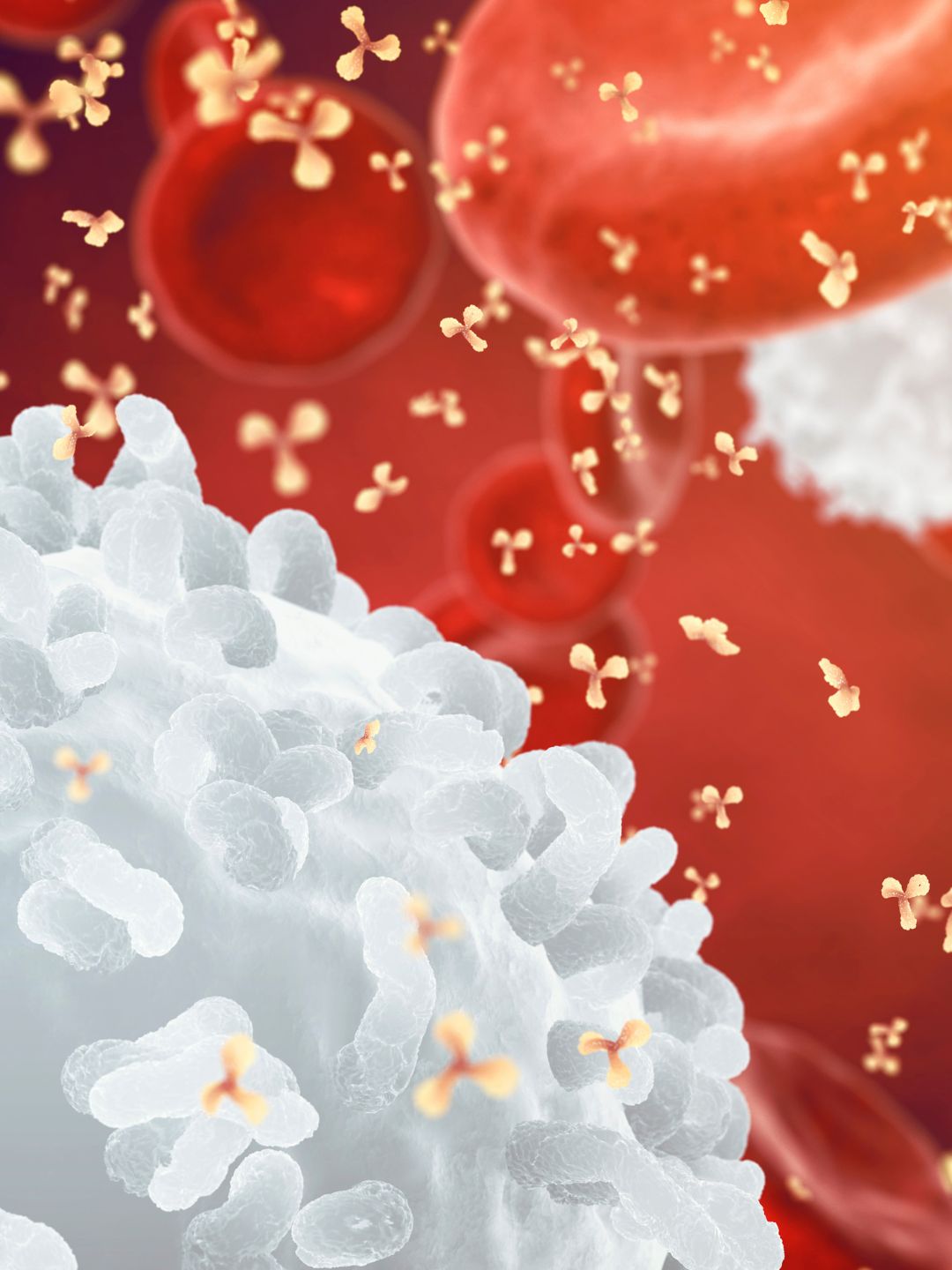
3. Efecto inmunológico (estimulación del sistema inmunológico)
La muerte de las células cancerosas bajo el efecto combinado del calor y los tratamientos conduce a la liberación de proteínas de estrés (proteínas de choque térmico, HSP).
Estas proteínas actúan como “señales de alarma” para el sistema inmunológico, atrayendo células inmunes al tumor.
Este mecanismo puede transformar un tumor llamado “frío” (indiferente al sistema inmune) en un tumor “caliente”, es decir, reconocible y atacable por las defensas naturales.
Esto crea un efecto de “vacuna in situ”: el cuerpo aprende a reconocer y combatir las células cancerosas.
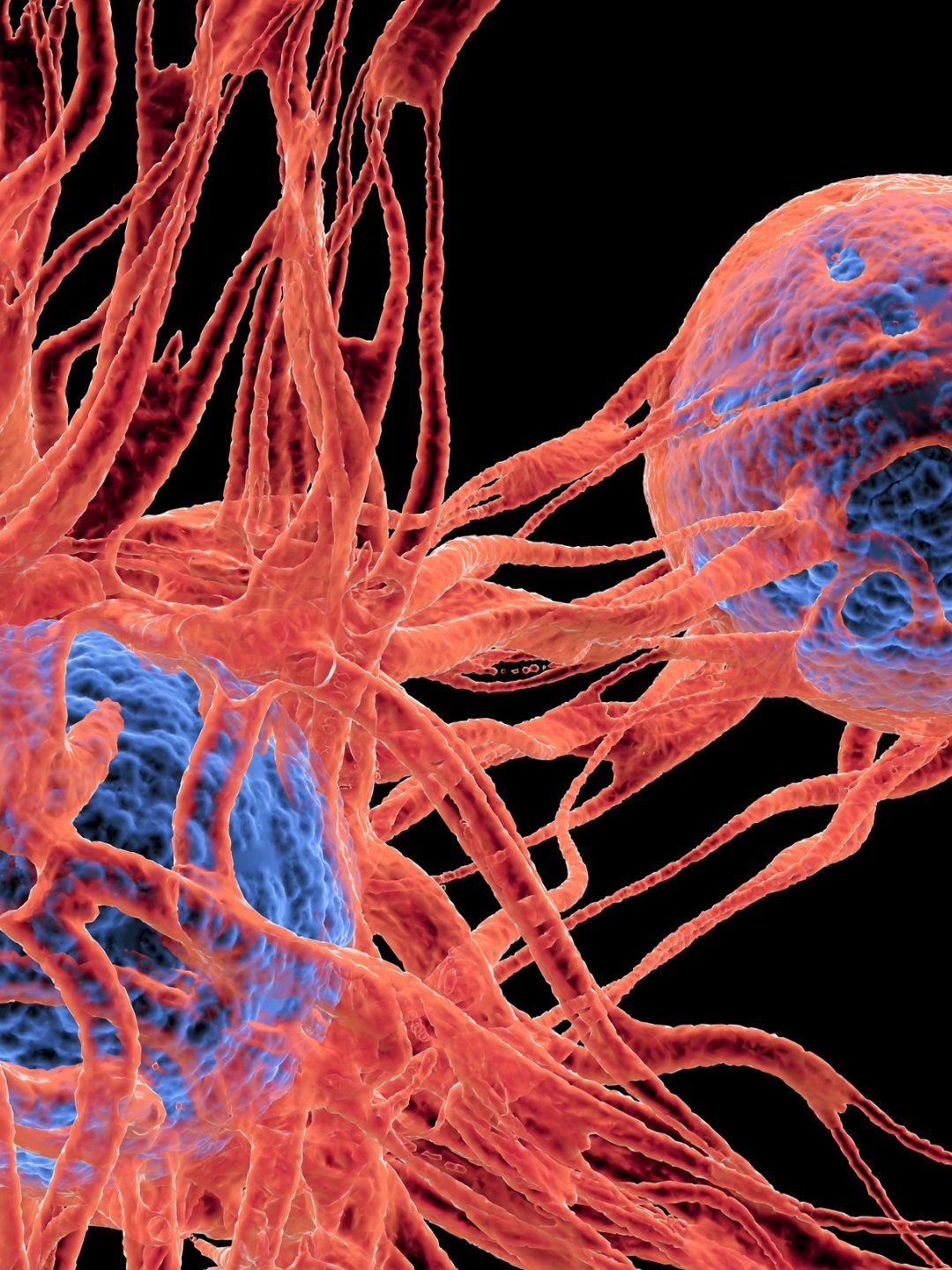
4. Efecto directo sobre la célula cancerosa
Las células tumorales tienen poca capacidad de disipación de calor debido a su desorganización vascular → por lo tanto se calientan más rápido que los tejidos sanos.
Por encima de 43 °C, algunas células cancerosas entran en apoptosis (muerte celular programada) o sufren daños irreversibles.
Hipertermia y calidad de vida
La hipertermia oncológica no solo mejora la eficacia de los tratamientos oncológicos, sino que también desempeña un papel fundamental en la calidad de vida de los pacientes. Combinada con radioterapia o quimioterapia, ayuda a aliviar el dolor, especialmente en casos de metástasis óseas, y acelera el tiempo de recuperación.
Numerosos estudios clínicos demuestran que la hipertermia permite:
- una reducción del dolor y de los síntomas relacionados con la enfermedad,
- una reducción de la fatiga y una mejor tolerancia a los tratamientos,
- una mejora en la función física y el bienestar emocional,
- beneficios duraderos, que persisten durante varios meses después de la terapia.
Sin aumentar significativamente los efectos secundarios graves, la hipertermia también actúa a nivel biológico (activación inmunitaria, protección tisular, inducción de proteínas de choque térmico). En algunos casos, ayuda a preservar órganos y funciones vitales, mejorando así la comodidad y la independencia del paciente.
En resumen, la hipertermia es un enfoque centrado en el paciente que combina la eficacia terapéutica con una mejora tangible en la calidad de vida, tanto con fines curativos como paliativos.


Hipertermia y supervivencia
La hipertermia, utilizada como tratamiento adyuvante a la radioterapia, la quimioterapia u otras terapias estándar, ha demostrado efectos significativos en la supervivencia global (SG) de pacientes con cáncer. Varios ensayos clínicos aleatorizados de fase III y metaanálisis muestran que, en ciertos cánceres agresivos, su incorporación a los protocolos estándar puede mejorar la supervivencia en un 20 %, un 50 % o incluso más del 100 % en casos específicos. Estos notables beneficios en la supervivencia se logran sin un aumento significativo de los efectos secundarios graves (niveles 3-4), y los estudios confirman que la hipertermia mantiene un perfil de seguridad favorable.
Ejemplos clínicos
Glioblastoma multiforme : un ensayo de fase I/II demostró que la hipertermia, combinada con el método estándar, duplicó la supervivencia a los 2 años (≈ 15% → 31%).
Cáncer de páncreas : En formas resecables, el ensayo HEAT indica una tasa de supervivencia a 5 años del 28,4 % con hipertermia frente al 18,7 % sin ella, lo que representa una mejora relativa de aproximadamente el 52 %. En casos avanzados, la hipertermia más quimioterapia prolonga significativamente la supervivencia general y la supervivencia libre de progresión.
Sarcomas de tejidos blandos : el ensayo EORTC 62961/ESHO-95 muestra que agregar hipertermia regional a la quimioterapia neoadyuvante duplica el tiempo de supervivencia libre de enfermedad y mejora la supervivencia a largo plazo.
Cánceres de cuello uterino, mama, cabeza y cuello, recto y vejiga : en estos tipos, varios ensayos de fase III o metanálisis informan mejoras en la supervivencia general, las tasas de respuesta completa (RC), la supervivencia sin recurrencia o sin enfermedad y, en el cáncer de vejiga, una reducción de la recurrencia después de la hipertermia intravesical.
¡Envíenos un correo electrónico!
Respondemos a todas sus preguntas.
info@clinicaleslilas.com
¡Llámenos!
Estamos aquí para escucharle.
614 067 537
¡Visítenos!
Estamos deseando conocerle.